İki ya da daha fazla kimyasal maddenin herhangi bir oranda bir araya gelerek oluşturduğu homojen karışıma çözelti denir. Diğer bir deyişle, bir maddenin başka bir madde içinde gözle görülemeyecek kadar küçük tanecikler hâlinde dağılarak homojen karışım oluşturması olayına çözünme, elde edilen karışıma da çözelti denir.
Bir çözeltiyi oluşturan maddelerden genellikle çok olanına çözücü, az olanına da çözünen denir. Doğada birçok çözücü ve çözünen madde vardır. Bilinen en iyi çözücü sudur. Birçok katı, sıvı ve gaz maddeler suda çözünür. Çözücü ve çözünen; katı, sıvı veya gaz olabilir. Buna göre çeşitli çözeltiler hazırlanabilir.
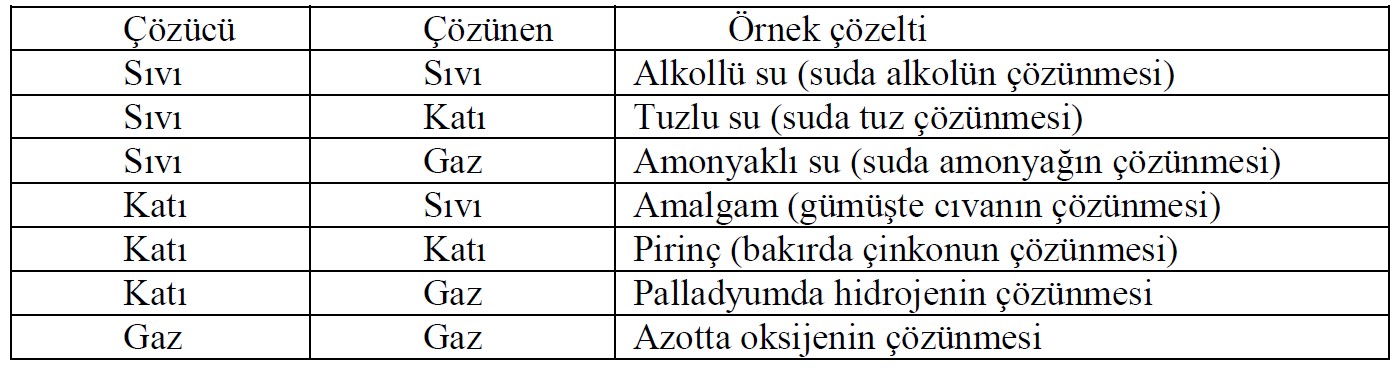
Çözücü – Çözünen Durumuna Göre Çözelti Örnekleri
Çözücü sıvı ise çözünenin sıvı, katı, gaz oluşuna göre üç türlü; çözücü katı ise çözünenin sıvı, katı, gaz oluşuna göre de üç türlü çözelti hazırlamak mümkündür. Çözücü gaz olduğunda gaz içinde sadece gaz çözündüğünden tek tür çözelti hazırlanabilir. Gazlar, katı ve sıvılarla homojen çözelti oluşturmazlar. Çözeltiler arasında en sık kullanılanlar; sıvıda katı, sıvıda sıvı, sıvıda gaz çözeltileridir. Bu tür çözeltiler, çözücüsü su ise “sulu çözelti” adını alır.
Çözeltiler hazırlanırken öncelikle hazırlanacak çözeltinin hacmine ve derişime göre gereken madde miktarı hesaplanır. Hesaplanan miktarda madde tartılarak veya bir hacim ölçüm aracı ile alınarak çözeltinin hazırlanacağı kaba aktarılır.
Çözeltisi hazırlanacak madde katı ise hassas terazide tartılarak alınır. Tartımlar ya direkt çözeltinin hazırlanacağı kaba yapılmalı ya da tartım kabı kullanılarak tartılan madde daha sonra çözelti kabına aktarılmalıdır. Bu durumda tartım kabındaki maddenin tamamının eksiksiz bir şekilde kaba aktarılmasına dikkat edilmeli, gerekirse çözücü ile yıkanarak kaba aktarılmalıdır. Kaba aktarılan madde hesaplanılan hacimde çözücü içinde çözülerek çözelti hazırlanır.
Çözelti hazırlamak için genellikle balon jojeler kullanılır. Hazırlanacak çözelti hacmine göre balon joje seçildikten sonra tartılan madde balon jojeye aktarılır. Daha sonra üzerine bir miktar çözücü eklenip iyice çalkalanarak maddenin tamamen erimesi sağlanır. Maddenin tamamı eridikten sonra balon joje çözücü ile hacim çizgisine tamamlanır. Böylece çözelti hazırlama işlemi tamamlanmış olur. Bazen de tartılan madde önce uygun bir kap içinde bir miktar çözücü ile tamamen çözündükten sonra balon jojeye aktarılıp çözücü ile istenen hacme tamamlanır. Bu durumda maddenin çözündüğü kap, çözücü ile iyice temizlenerek balon jojeye aktarılmalıdır.
Çözeltisi hazırlanacak madde sıvı ise hesaplanan madde pipet veya uygun bir hacim ölçüm kabı ile alınarak çözelti kabına aktarılır, üzerine hesaplanan hacimde çözücü eklenerek çözelti hazırlanır. Hidroklorik asit, sülfürik asit gibi kuvvetli asitlerin çözeltisi hazırlanırken öncelikle balon jojeye bir miktar saf su konulmalı, üzerine asit azar azar ilave edilmeli daha sonra da saf su ile hacim çizgisine tamamlanmalıdır.
Çözelti hazırlama esnasında ısı yükselmesi meydana gelmişse bu durumda hazırlanan çözeltinin oda sıcaklığına kadar soğuması beklendikten sonra çözelti hacim çizgisine tamamlanmalıdır.
Çözelti hazırlanıp hacim çizgisine tamamlandıktan sonra hemen kullanılmayacaksa balon jojede tutulmamalı mutlaka uygun bir çözelti şişesine aktarılarak muhafaza edilmelidir.
Hazırlanan çözeltinin üzerine mutlaka etiket yapıştırılmalıdır.
Etikette mutlaka şu bilgilere yer verilmelidir:
- Çözeltinin adı,
- Derişimi,
- Hazırlandığı tarih,
- Hazırlayanın ismi (Her zaman gerekmeyebilir.).
Çözelti Çeşitleri Nelerdir?
1- Yüzde Solüsyonlar
100 ml çözücü yani eriten içerisinde eriyen maddenin gram veya ml olarak miktarını gösterir ve analiz sonuçlarında bu tip çözeltiler g/ml, ml/ml, şeklinde belirtilir. Çözünen madde eğer katı ise ve gram olarak tartılarak çözelti hazırlanmışsa bu çözeltiler % g (g/ml) olarak ifade edilir. Bazı katı maddelerin kristallerinin ihtiva ettiği su göz önünde bulundurulur ve hesaba katılır. Örneğin % 4 sodyum hidroksit (NaOH) çözeltisi hazırlamak istersek 4 g NaOH bir hassas terazide tartılır ve 100 ml distile suda eritilir. Bu şekilde istenilen %4’lük çözelti hazırlanmış olur.
Yüzde çözeltisi hazırlanan yani çözünen madde sıvı ise, % ml (ml/ml) olarak ifade edilir. Bazı sıvı maddeler ticari olarak yüzde yüz saf olarak bulunmaz. Örneğin hidroklorik asit (HCl) piyasada % 37’lik bir çözelti hâlinde bulunur. Eğer biz % 10’luk bir HCl çözeltisi hazırlamak istenirse piyasada bulunan % 37’lik HCl çözeltisinden 10 ml alınır ve 90 ml distile suya karıştırılır. Hazırlayacağımız bu 100 ml sıvının içerisinde 3,7 g HCl bulunur.
2- Ayarlı Solüsyonlar
Molar Solüyonlar: Bir litre çözeltide çözünmüş maddenin mol sayısı o çözeltinin molaritesine eşittir. “M” harfiyle gösterilir. Litresinde mol ile ifade edilen miktarda madde bulunduran çözeltilere de molar çözeltiler denir.
Osmolar Solüsyonlar: Litresinde 1 osmol gram madde bulunan; aynı osmotik basınca sahip olan yani birbirleriyle aynı sayıda osmotik bakımdan aktif partikül bulunduran çözeltilere izotonik çözelti denir.
Normal Solüsyonlar: Litresinde 1 eş değer gram madde bulunan çözeltilerdir. Normalite (N), 1 litre çözeltide çözünmüş maddenin eş değer gram (ekivalan gram) sayısını ifade eden bir kavramdır.
3- Doymuş Solüsyonlar
Doymuş çözelti, sabit basınç ve sıcaklıkta çözebileceği en fazla maddeyi çözmüş çözeltiye verilen addır.
4- Tampon Solüsyonlar
Asidik ve bazik madde ilavesine karşı hidrojen iyonu konsantrasyonundaki değişmeleri önleyen çözeltilere tampon çözeltiler denir.
5- Formal Çözelti
Bir çözeltinin formalitesi, herhangi bir maddenin bir litrelik çözeltisinde bulunan formül gram sayısıdır. Kısaca F harfiyle gösterilir.
6- Molal Çözelti
Bir çözeltinin molalitesi, 1000 g çözücüde çözünen maddenin mol sayısıdır. Kısaca “m” harfiyle gösterilir.
Çözelti Hazırlarken Dikkat Edilmesi Gereken Hususlar
1- Çözelti hazırlarken çözücü belirtilmemişse çözücü olarak her zaman distile su kullanılır.
2- Asit çözeltiler hazırlanırken derişik asitlere su ilave edilmez. Aksine, derişik asit cam kabın cidarından distile suya yavaş yavaş ve musluk suyu altında soğutularak ilave edilir.
3- Bazen çözeltilerin kullanım amacına göre deiyonize veya redistile su kullanılır.
4- Çözelti hazırlamada kullanılan tüm malzeme çok iyi yıkanmalı ve birkaç defa distile sudan geçirilmelidir.
5- Tartım yapılırken kullanılan kimyasal maddelerin havadan nem kaparak bozulmaması için madde alındıktan sonra ambalajların ağzı derhal kapatılmalıdır.
6- Kimyasal maddeler hazırlanmadan önce bilgi etiketleri incelenmelidir.
7- Tartım kabında kalan kimyasalın bulaşısını solüsyon kabına pisetle iyice yıkanmalıdır.
8- Çözünen madde ilave edildikten sonra balona volümünün yarısı kadar çözücü eklenerek erime gerçekleşene dek hafifçe karıştırılır.
9- Katı madde tamamen eridikten sonra kabın hacim çizgisine kadar distile suyla tamamlanır.
Kaynak: MEGEP | Milli Eğitim Yayınları