Evrendeki her şeyin çok küçük parçacıklardan oluştuğu düşüncesi milattan önceki yıllara dayanır. Atom düşüncesi ilk defa eski Yunan’da doğmuştur. Atom fikrinin doğmasındaki temel neden maddeyi daha küçük parçalara ayırmaya çalışmaktı. Örneğin bakır bir teli iki eşit parçaya ayırdığınızı düşününüz. Her bir parçayı tekrar tekrar iki parçaya ayırdığınızda bir noktadan sonra parçalar yeniden ikiye ayrılamayacak hâle gelir. İşte bu düşünceden yola çıkılarak maddenin sonunda kendinden daha küçük parçacıklara ayrılamayan bu küçük parçacıkların bir araya gelmesiyle oluştuğu kabul edilmiştir.
Bu kurama dair elimizdeki en eski yazılı belgeler Yunan filozofları Democritus (Demokritus) (MÖ 460-370) ve Leucippus (Lökipyus) (MÖ 480-420)’a aittir.
Tarihi çok eskilere dayanmasına rağmen atom fikri çok uzun zaman ilgi görmemiş ve kanıtlanamamıştı. Bunun önemli nedenlerinden biri bu kuramın tamamen düşünceye dayalıolmasıdır. Ayrıca Aristoteles (Aristo) (MÖ 384-322)’in bu düşünceyi desteklememesi de maddenin atomlardan oluştuğu fikrinin benimsenmesini geciktirmiştir.
Bu yazımızda, Dalton Atom Modeli, Thomson Atom Modeli, Rutherford Atom Modeli, Bohr Atom Modeli, Schrödinger Atom Modeli ve Modern Atom Modeli hakkında bilgi vermeye çalışacağız.
1- Dalton Atom Modeli

John Dalton‘un 1805 yılında bugünkü atom modelinin ilk temellerini attığı modelidir. Daltonun atom kuramına göre elementler kimyasal bakımdan birbirinin aynı olan atomlar içerirler. Farklı elementlerin atomları birbirinden farklıdır. Bu atom teorisine göre kimyasal bir bileşik iki veya daha çok sayıda elementin basit bir oranda birleşmesi sonucunda meydana gelir. Kimyasal tepkimelere giren maddeler arasındaki kütle ilişkilerine istinaden, Dalton atomların bağıl kütlelerini de bulmuştur. Modern atom kuramı Dalton’un kuramına dayanır ancak bazı kısımları değiştirilmiştir.

Atomun parçalandığını, elementlerin birbirinin aynı atomlardan değil, izotoplarının karışımından meydana geldiğini biliyoruz. Daltonun atom teorisi kimyasal reaksiyonların açıklanmasına, maddenin anlaşılmasına ve atomun temel özelliklerinin ortaya atılmasına oldukça büyük yararlar sağlamıştır. Bu sebeple ilk bilimsel atom teorisi olarak kabul edilir.
Dalton Atom Kuramı Üç Varsayıma Dayanır;
1. Elementler Atom adı verilen küçük bölünemeyen taneciklerden oluşmuştur. Atomlar kimyasal tepkimelerde oluşmazlar ve bölünmezler.
2. Bir elementin tüm atomlarının kütlesi ve diğer özellikleri aynı, diğer elementlerin atomlarından farklıdır.
3. Kimyasal bir bileşik iki ya da daha fazla elementin basit bir oranda birleşmesi ile oluşur.
Dalton atom teorisi kimyasal değişme konularının da daha iyi tanımlanmasına olanak sağlar:
1. Kütlenin korunumu: Bir kimyasal reaksiyonda reaksiyona giren maddelerin kütleleri toplamı çıkan maddelerin kütleleri toplamına eşittir
2. Sabit oranlar Yasası: İki element birden fazla bileşik meydana getiriyorsa, birleşen iki elementin farklı miktarları arasında ağırlıkça tam sayılarla ifade edilen basit bir oran bulunur. Örneğin: H2O da 2 g hidrojenle 16 g oksijen birleşirken, OH de 1 g hidrojenle 16 g oksijen birleşmiştir. Buradan her iki bileşikte de aynı miktar oksijenle birleşen 2 g hidrojen ve 1 g hidrojeni birbirine oranlarsak 2 sayısınıelde ederiz.
2- Thomson Atom Modeli

Thomson değişik gazlarda yapmış olduğu deneylerle her atomun elektron yükünün kütlesine oranını hesaplayarak elektronu keşfetmiştir. Elektron veren atomun artı (+, pozitif) yüklü olacağını ispatlamış, atom içerisinde proton ve elektronun homojen olarak dağıldığını tanımlamıştır, Bu yüzden bu modele üzümlü kek modeli de denilmektedir.
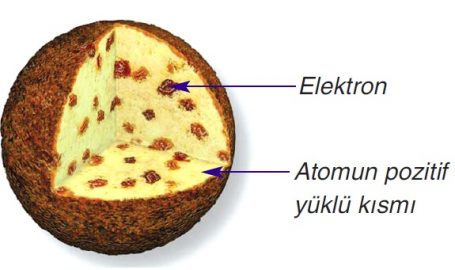
Rutherford Atom Modeli ile proton ve elektronun homojen dağıldığı ilkesi çürütülmüştür.
1. Atom artı yüklü maddeden oluşmuştur
2. Elektronlar bu artı madde içinde gömülüdür ve hareket etmezler.
3. Elektronların kütleleri çok küçüktür bu yüzden atomun tüm kütlesini bu artı yüklü maddeoluşturur.
4. Atom küre şeklindedir.
3- Rutherford Atom Modeli

Atomun yapısının açıklanması hakkında, önemli katkıda bulunanlardan birisi de Ernest Rutherford olarak bilinir. Rutherford‘dan önce Thomson atom modeli geçerliydi. Bu modele göre, atom küre seklindedir. Ve küre içerisinde proton ve elektronlar bulunmaktadır. Acaba bu proton ve elektronlar atom içerisinde belirli bir düzene mi, yoksa rastgele bir dağılım içerisinde mi bulunuyorlar? Bu sorunun cevabı daha bulunamamıştı. Rutherford bu sorunun cevabi ve Thomson atom modelinindoğruluk derecesini anlamak için yaptığı alfa (a) parçacıkları deneyi sonucunda bir model geliştirmiştir.
Polonyum ve radyum bir a-işini kaynağıdır. Rutherford, bir radyoaktif kaynaktan çıkan a-taneciklerini bir demet halinde iğne ucu büyüklüğündeki yarıktan geçirdikten sonra, kalınlığı 10-4 cm kadar olan ve arkasında çinko sülfür (ZnS) sürülmüş bir ekran bulunan altın levha üzerine gönderdi.
Altın levhayı geçip ekran üzerine düşen a-parçacıkları ekrana sürülen ZnS üzerinde ışıldama yaparlar. Böylece metal levhayı geçen a – parçacıklarını sayma imkanı elde edilir. Rutherford, yaptığı deneylerde metal levha üzerine gönderilen a- parçacıklarının % 99,99 kadarının ya hiç yollarında sapmadan ya da yollarından çok az saparak metal levhadan geçtiklerini, fakat çok az bir kısmının ise metale çarptıktan sonra büyük bir açı yaparak geri döndüklerini gördü. Rutherford daha sonra deneyi altın levha yerine, kursun, bakir ve platin metallerle tekrarlandığında ayni sonucu gördü. Kinetik enerjisi çok yüksek olan ve çok hızlı olarak bir kaynaktan çıkan a – parçacıklarının geriye dönmesi için;
1. Metal levhada pozitif kısmın olması,
2. Bu pozitif yüklü kısmın kütlesinin (daha doğrusu yoğunluğunun) çok büyük olması gerekir.
Bu düşünceden hareketle Rutherford, yaptığı bu deneyden su sonuçlan çıkardı.
Eğer, a tanecikleri atom içerisindeki bir elektrona çarpsaydı, kinetik enerjileri büyük olduğu için elektronu yerinden sökerek yoluna devam edebilirlerdi. Ayrıca, a – taneciği pozitif, elektron negatif olduğundan geriye dönüş söz konusu olmaması gerekirdi. Bu düşünceyle hareket eden Rutherford, metale çarparak geriye dönen alfa parçacıklarının sayısı metal levhadan geçenlere oranla çok küçük olduğundan ; atom içerisinde pozitif yüklü ve kütlesi büyük olan bu kısmın hacmi, toplam atom hacmine oranla çok çok küçük olması gerektiğini düşünerek, bu pozitif yüklü kısma çekirdek dedi.
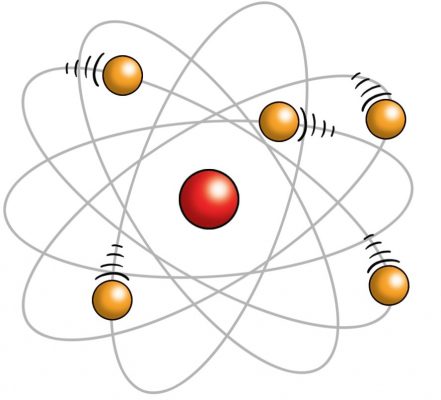
Rutherford, atomun kütlesinin yaklaşık olarak çekirdeğin kütlesine eşit olduğunu ve elektronların da çekirdek etrafındaki yörüngelerde döndüğünü ileri sürmüştür. Buna göre, Rutherford atomu güneş sistemine benzetmiş oluyordu. Rutherford atom modelini ortaya koyduğunda nötronların varlığı daha bilinmiyordu. Günümüzde ise çekirdeğin proton ve nötronlar içerdiği ve bunların çekirdeğin kütlesini oluşturduklarına inanılmaktadır. Rutherford’un ortaya koyduğu atom modelinin boyutlarını da anlamak önemlidir. Bunu şu şekilde ifade edebiliriz. Eğer, bir atomun çekirdeği bir tenis topu büyüklüğünde olsaydı, bu atom büyük bir stadyum büyüklüğünde olurdu.
He atomu 2 proton, 2 nötron ve 2 elektrondan oluşur. Bir He atomunun 2 elektronu tamamen uzaklaştırılırsa geriye +2 yüklü helyum iyonu (He+2) kalır. Bu iyona alfa (a) parçaciği (alfa işini) denir.
Bir atomu a-taneciği ile incelemek, bir şeftaliyi uzun bir iğne ile incelemeye benzer, iğnenin şeftalinin ortasında sert bir şeye çarptığını tespit ederek şeftali çekirdeğinin varlığını ve büyüklüğünü onu hiç görmeden anlamak mümkündür. Bu arada şeftali ile çekirdeğinin büyüklüğü ve atom ile çekirdeğinin büyüklüğünün aynı oranda olamayacağı unutulmamalıdır.
4- Bohr Atom Modeli
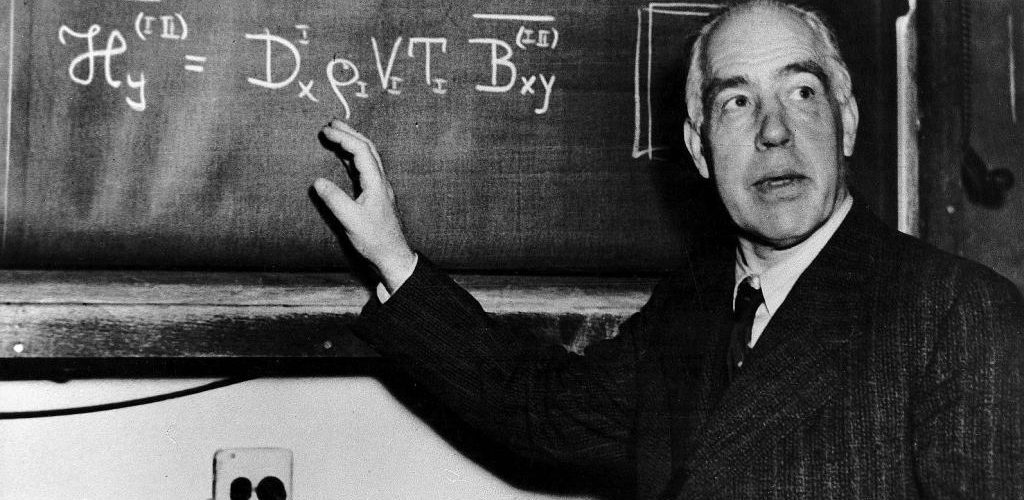
Niels Hendrik Bohr 1919 yılında kendinden önceki Rutherford Atom Modeli atom modellerinden yaralanarak yeni bir atom modeli fikrini öne sürdü.
Çekirdeğe en yakın enerji seviyesine dairesel hareket yapan elektron kararlıdır, ışık yaymaz.Elektron’a yeterli enerji verilirse elektron bulunduğu enerji seviyesinden daha yüksek enerji seviyesine sıçrar. Atom bu durumda kararsızdır. Kararlı hale gelmek için elektron tekrar eski enerji seviyesine dönerken almış olduğu enerji seviyesini eşit enerjide bir Foton (ışın taneciği) fırlatır. Atom bu şekilde ışıma yaparmış.
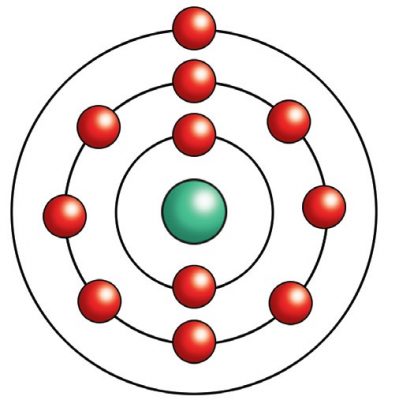
Buraya kadar anlatılan atom modellerinde, atomun çekirdeğinde, (+) yüklü proton ve yüksüz nötronların bulunduğu, çekirdeğin etrafında dairesel yörüngelerde elektronların dolaştığı ifade edildi. Bu elektronların çekirdek etrafında nasıl bir yörüngede dolaştığı, hız ve momentumlarının ne olduğu ile ilgili bir netice ortaya konmadı. Bohr ise atom teorisinde elektronların hareketini bu noktadan inceledi.
1913 yılında Neils Bohr, hidrojen atomunun spektrum çizgilerini ve Planck’ın kuantum kuramını kullanarak Bohr kuramını ileri sürdü. Bu bilgiler ışığında Bohr postulatları şöyle özetlenebilir.
1. Bir atomdaki elektronlar çekirdekten belli uzaklıktaki yörüngelerde hareket eder ve bu yörüngelerdeki açısal momentumu h/2pi’nin tam katlarıdır. Her kararlı halin sabit bir enerjisi vardır.
2. Her hangi bir kararlı enerji seviyesinde elektron dairesel bir yörüngede (orbitalde) hareket eder. Bu yörüngelere enerji düzeyleri veya kabukları denir.
3. Elektron kararlı hallerden birinde bulunurken atom ışık (radyasyon) yayınlamaz. Ancak, yüksek enerji düzeyinden daha düşük enerji düzeyine geçtiğinde, seviyeler arasındaki enerji farkına eşit bir ışık kuantı yayınlar. BuradaE = Eson-Eilk bağıntısı geçerlidir.
4. Elektron hareketinin mümkün olduğu kararlı seviyeler, K, L, M, N, O gibi harflerle veya en düşük enerji düzeyi 1 olmak üzere, her enerji düzeyi + bir tam sayı ile belirlenir ve genel olarak “n” ile gösterilir, (n: 1,2,3 …¥)
Bugünkü bilgilerimize göre; Bohr kuramının, elektronların dairesel yörüngelerde hareket ettikleri, ifadesi yanlıştır.
5- Schrödinger Atom Modeli

Atomun dalga mekaniği modeli, daha önce, atomun yapısı üzerinde çalışmaların, geçerli yanlarının birleştirilmesiyle ortaya çıkmıştır. Bu modelin gelişmesinde yararlanılan fikirlerden ya da çalışmalardan önemli olanlar aşağıda gösterilmiştir. Bunlar;
1. Broglie’nin, elektronun, partikül özelliği yanında, dalga özelliğine de sahip olduğu hakkındaki çalışmaları.
2. Bohr tarafından ileri sürülen atomun çekirdeği etrafında sabit enerji seviyelerinin bulunduğugerçeği.
3. Heisenberg tarafından gerçekleştirilen belirsizlik prensibi.
1926 yılında Avusturyalı fizikçi Schroedinger (1887-1961), atomun dalga mekaniği modelinigeliştirmiştir. Elementlerin tayflarının incelenmesinden, atomların çekirdekleri etrafında belirli sabit enerji seviyelerinin bulunduğu, deneysel olarak açıklanmıştır. Schroedinger, Bolır’un çalışmalarından, bu gerçeği almıştır. Broglie’nin atomun, pozitif yüklü çekirdeğinin titreşen elektron dalgaları ile sarılı bir yapıya sahip olduğu hakkındaki fikrini de benimsemiştir.
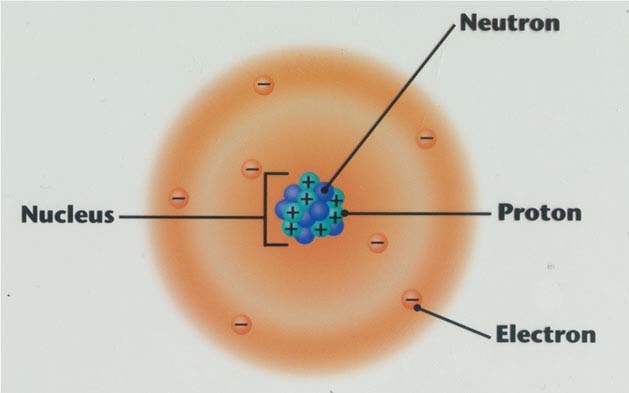
Heisenberg’in belirsizlik ilkesine göre, elektronların yeri ve hızı aynı anda tespit edilemeyeceklerine göre, elektronlar için Bohr modelinde olduğu gibi belirli yörüngelerden bahsedilemez. Elektronlar çekirdeğin pozitif alanı içinde üç boyutlu negatif yüklü dalgalar (bulutlar) gibi düşünülmelidir.
Schroedinger, bu üç görüşü birleştirdiği birbirini doğrulayan bir denklem geliştirmiştir. Bu denklem, Schroedinger denklemi olarak bilinir. Atomun dalga mekaniği modelini (modern atom teorisinin) teorik esasını verir.
Modern atom teorisinde, elektronlar belirli yörüngelerde dolaşan tanecikler gibi değil, çekirdeği çevreleyen elektron bulutları halinde kabul edilir. Bunların bulunma ihtimalinin en çok olduğu yerler, aldıkları biçimler ve büyüklükleri bulunmuştur. Bu özellikleri belirlemek için dört kuantum sayısındanyararlanılmıştır.
6- Modern Atom Modeli
En son ortaya konan Bohr atom modeli başarılı bir model olmuş ama maalesef çok elektronlu atomlarda kullanılamıyordu. Modern atom modelinde elektronların yörüngelerde sabit hızla dönmeleri doğru değildir. Çünkü elektronlar için yer ve hız bilgileri sadece olasılık olabilir.
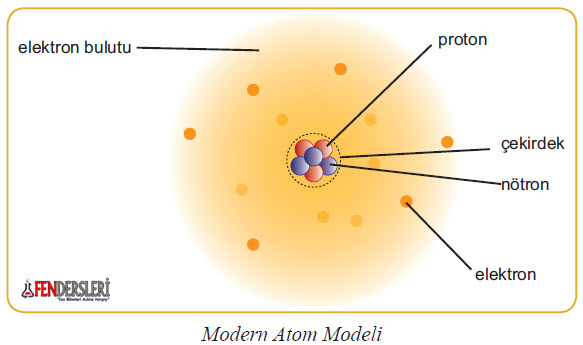
Modern Atom Modelinin Varsayımları Nelerdir?
1. Elektronlar, çekirdeğin çevresinde belirli bir enerji seviyesine sahip bir şekilde bulunurlar.
2. Elektronlardaki enerji seviyelerine “Baş Kuant Sayısı” denilmektedir ve “n” ile ifade edilir.
3. Baş kuant sayısı, orbitallerin (elektronların atom çekirdeği etrafındaki yörüngelerde bulunma olasılığının en fazla olduğu hacimsel bölgeler) çekirdeğe olan ortalama uzaklıklarını ve enerjisinigösterir.
4. Çekirdekten uzaklaşıldıkça enerji artar. Çünkü protonların elektronları çekim gücü azalır.
5. Elektronlar, hem kendi etrafında (spin hareketi) hemde çekirdek etrafında (orbital hareket) dönerler.
6. Atomu çekirdeğinin birinci enerji seviyesinden itibaren her enerji düzeyinde birer tane “S Orbitali” bulunur ve en fazla 2 elektron alır.
7. Atomu çekirdeğinin ikinci enerji seviyesinden itibaren her enerji düzeyinde “P Orbitali” bulunur veen fazla 6 elektron alabilirler. px, py ve pz şeklinde 3 çeşittir. Bunların enerji seviyeleri eşittir.
8. Atomu çekirdeğinin üçüncü enerji seviyesinden itibaren her enerji düzeyinde “D Orbitali” bulunur ve en fazla 10 elektron alır. 5 çeşittir ve enerji seviyeleri eşittir.
9. Atomu çekirdeğinin dördüncü enerji seviyesinden itibaren her enerji düzeyinde “F Orbitali”bulunur ve en fazla 14 elektron alır. 7 çeşittir ve enerji seviyeleri eşittir.
Elektronlar, orbitalleri doldururken ilk olarak enerjisi az olan orbitali doldururlar. Bir orbitalin enerjisi çekirdeğe yaklaştıkça azalır. Aynı temel enerji seviyesindeki orbitallerin enerjileri sıralaması ise “s < p < d < f” şeklindedir. Dolayısıyla en az enerjiye sahip orbital 1s orbitalidir. Bir orbital en fazla 2 elektron taşır ve bu elektronların dönme yönleri zıttır. Bu ilkeye ise “Pauli İlkesi, Pauli Dışlama İlkesi veya Pauli Dışarlama İlkesi” denir.
Not: Geçmişten günümüze atom fikrinde birçok değişiklik olmuştur. Atom konusunda her şeyi bildiğimizi söylememiz mümkün değildir. Atom konusunda çalışmalar devam etmektedir.
Kaynak: